Содержание
Беременность как средство борьбы с ожирением
Ожирение как проблема – феномен, свойственный исключительно развитому человеческому обществу. Для первобытного сообщества, равно как и для дикой природы, скорее характерна другая проблема – голода. Почему здоровая упитанность издавна служила показателем физического и социального благополучия – вспомним хотя бы изображения пышнотелых «первобытных Венер». В современном обществе подобная реакция сохранилась, пожалуй, лишь в отношении детей и домашних любимцев. Что же такое ожирение – «вредная привычка» или болезнь? Почему так трудно избавиться от лишних килограммов? Возможна ли коррекция избыточного веса? Исследования на модельных объектах – мышах с генетически обусловленным ожирением – позволяют пролить свет на эту современную «чуму» неголодного человечества.
В настоящее время в индустриально развитых странах мало кто не обеспокоен проблемой лишнего веса: в той же Америке, например, говорят даже об эпидемии ожирения. Проблема ожирения страшна не только тем, что носители лишних килограммов далеки по внешнему виду от эфемерных созданий, принятых современной модой за идеал, и даже не тем, что им приходится тратить больше денег и времени на покупку одежды и обуви. Главное, ожирение неизбежно влечет за собой вереницу заболеваний. У людей, страдающих ожирением, возрастает риск смерти от таких болезней, как диабет, гипертония, закупорка сердечных сосудов, инсульт, заболевания желчного пузыря и печени, рак, даже от остановки дыхания во сне…
Уже много лет ученые и медики пытаются найти способы предотвращения развития ожирения. Хорошо известно, что отложенный про запас жир – это попросту лишняя, не израсходованная энергия, поступившая с пищей. Еще 10 лет назад считалось, что ожирение является результатом лености и переедания, поэтому лечить его легко: надо просто меньше есть и больше двигаться. Основанные на подсчете съеденных калорий жесточайшие диеты приводили у большинства людей к временному снижению веса, который неуклонно стремился восстановиться после снятия ограничений.
Однако в 1994 г. произошли два события, в корне изменившие наше отношение к проблеме лечения ожирения. Во-первых, был открыт гормон жировой ткани лептин. Во-вторых, описана меланокортиновая система мозга, через которую этот гормон осуществляет регуляцию метаболизма жиров.
Лептин – контролер жировых запасов
Оказалось, что жир – это не просто «подушка», портящая фигуру, но еще и эндокринный орган, нарабатывающий белковый гормон. Если же орган выделяет в кровь гормоны, значит, он способен влиять на функции других органов и физиологических систем. Таким образом, именно благодаря лептину жир как бы«борется» за свое существование (Cone et al., 2001).
По мере увеличения размера жировых клеток растет и уровень экскретируемого ими лептина. В высоких концентрациях он препятствует дальнейшему развитию ожирения: подавляет аппетит, усиливает расход энергии. Однако если резко сократить долю жира в организме (например, за счет липосакции или диеты), то снижается и уровень лептина и, соответственно, снимается его ингибирующее действие на аппетит. Поэтому у людей, которые резко похудели, также резко падает уровень лептина и увеличивается аппетит. Другими словами, лептин препятствует как дальнейшему развитию ожирения у людей с нормальным весом, так и снижению веса у полных людей. Почему же тогда люди все-таки способны так сильно увеличить вес? Да потому что при достижении в крови очень высоких уровней лептина у них развивается нечувствительность к этому гормону. Но это уже совсем другая история.
Кто отдаст ужин врагу?
Итак, лептин способен влиять на аппетит, т. е. на сложный физиологический признак, называемый пищевым поведением. Как и все формы поведения, оно регулируется различными отделами мозга и прежде всего гипоталамусом. В конце 1990-х годов удалось установить, что лептин действует на аппетит через меланокортиновую систему (МК-систему) гипоталамуса.
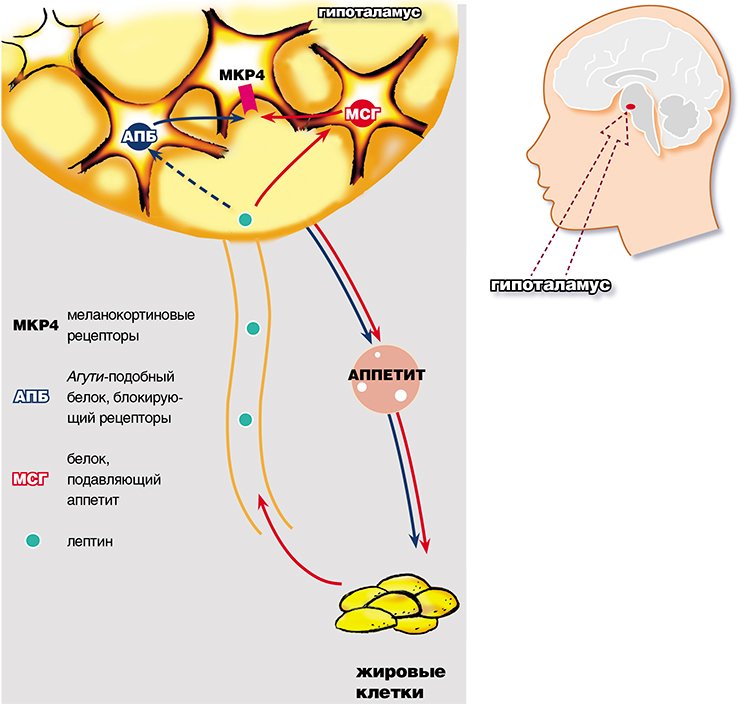
Для начала сделаем небольшое отступление на тему семейства особых меланокортиновых гормонов. К этой группе относятся меланоцитстимулирующие гормоны (МСГ), в том числе регулирующие выработку пигментов, и адренокортикотропный гормон (АКТГ), регулирующий функцию надпочечников. Все они имеют общую молекулу-предшественник, сходные последовательности аминокислот в структуре и распознаются рецепторами, относящимися к одному семейству.
Поначалу, когда была обнаружена общность этих гормонов, никто не мог и предположить, что эта система имеет также свое локальное представительство в гипоталамусе, которое и занимается регулированием поступления и расходом энергии. Именно на эту так называемую МК-систему гипоталамуса и действует лептин. Для того чтобы понять механизм его действия, кратко познакомимся с функцией меланокортиновой системы.
Нейроны гипоталамуса способны нарабатывать один из меланоцитстимулирующих гормонов (α-МСГ), который активирует в нем особые меланокортиновые рецепторы, что, в свою очередь, и приводит к подавлению аппетита. Поэтому гипоталамический α-МСГ относят к анорексигенным факторам – факторам, подавляющим желание есть. Если бы наряду с анорексигенными не существовало орексигенных факторов, усиливающих аппетит, то не было бы и проблемы ожирения. Возникла бы, правда, более страшная проблема – умереть с голоду при обилии пищи.

Природа разумна: наряду с анорексигенным α-МСГ в других нейронах того же гипоталамуса нарабатывается орексигенный пептид (Агути-подобный белок, АПБ). АПБ способен блокировать связывание α-МСГ с его рецепторами и в результате усиливать аппетит. От соотношения в гипоталамусе продукции анорексигенных и орексигенных факторов – α-МСГ и АПБ – и зависит то, с какой легкостью вы способны отказаться от ужина, следуя рекомендациям диетологов.
Лептин является дирижером этого ансамбля: он стимулирует синтез α-МСГ и подавляет синтез АПБ, что приводит к снижению аппетита. Если уровень в крови лептина падает, то происходит обратный эффект: аппетит растет. В естественных условиях у диких видов проблемы ожирения нет: способность лептина приводить аппетит в соответствие с имеющимися запасами жира является эффективным механизмом адаптации к условиям голода. При недостатке пищи события разворачиваются следующим образом: снижается доля жира, снижается уровень лептина, повышается аппетит и одновременно снижается скорость расходования имеющихся энергетических запасов.
Генетическое ожирение
Возвращаясь к проблеме ожирения, еще раз уточним, какие же изменения в МК-системе гипоталамуса неминуемо должны привести к повышению аппетита и увеличению веса. Стимуляция аппетита будет достигнута в одном из следующих случаев: 1) снизится продукция α-МСГ; 2) снизится число меланокортиновых рецепторов или их способность связывать α-МСГ; 3) повысится продукция АПБ или другого блокатора меланокортиновых рецепторов.
Правильность этого заключения подтверждается тем, что сейчас созданы линии лабораторных мышей с искусственными мутациями, нарушающими работу генов названных белков, а значит, и их продукцию. В результате эти мыши страдают так называемым меланокортиновым ожирением. Кстати сказать, мыши появились на нашей сцене неслучайно. К счастью для нас, система регуляции веса тела схожа у всех млекопитающих, в том числе у человека и мышей — удобных объектов физиологических исследований.
Отдельно хочется выделить одну линию мышей – С57Bl/6J, у которых мутация, приводящая к ожирению, возникла спонтанно. Ее можно рассматривать как поощрительный приз ученым, исследующим механизмы развития МК-ожирения. Вообще-то эта линия мышей была давно известна тем, что в ней возникают мутации в локусе Агути, который контролирует цвет шерсти. Мыши с доминантной мутацией этого локуса Agouti yellow (А у ) имеют желтый цвет шерсти, а с рецессивной мутацией nonagouti (a) – черный. У желтых мышей после полового созревания развивается ожирение и диабет 2-го типа, чего черные мыши счастливо избегают.
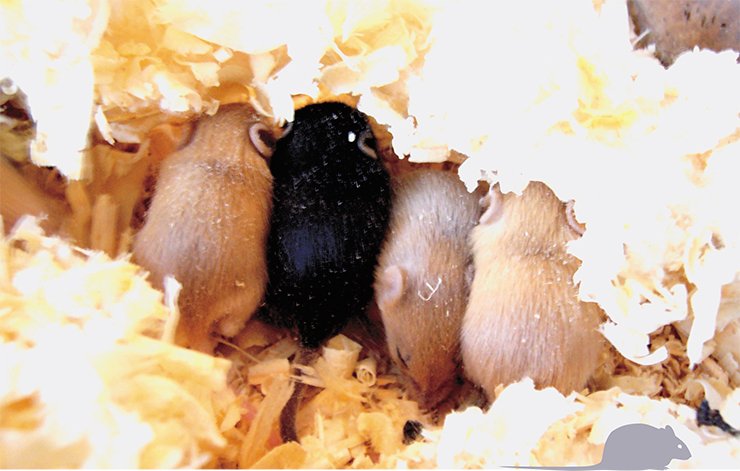
Связь между цветом шерсти и склонностью к ожирению долгое время оставалась загадкой, пока Бультман с соавторами (1992) не показали, что мутация Agouti yellow нарушает характер экспрессии, т. е. работы гена Агути. Если в норме этот ген экспрессируется только в клетках кожи, где и влияет локально на цвет шерсти, то у мышей с мутацией А у он начинает работать во всех тканях, в том числе, в гипоталамусе. Оказалось, что продукт гена
Агути – Агути-белок – так же, как и орексигенный агутиподобный белок гипоталамуса, препятствует связыванию α-МСГ с рецепторами. Выступая в роли добровольного помощника АПБ, он день за днем повышает аппетит. А хроническое переедание уже неминуемо приводит к ожирению…
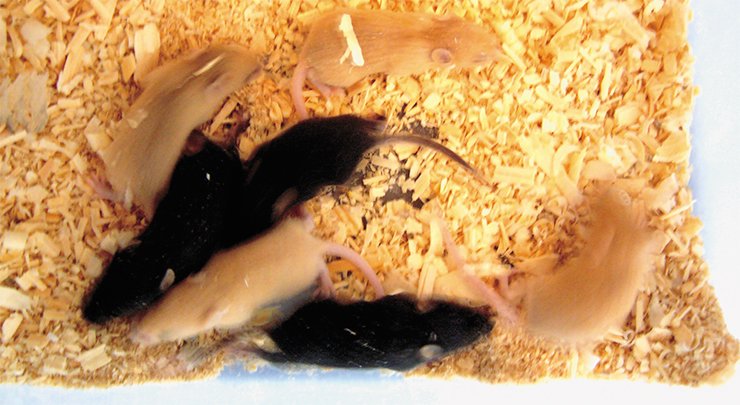
Мыши линии С57Bl/6J с мутацией Ау особенно привлекательны для исследователей тем, что их можно рассматривать как модель генетической формы ожирения, встречающегося у человека. Конечно, далеко не все люди, страдающие ожирением, обращаются к врачам с просьбой исследовать их геном. Однако у большинства из тех, кто обратился, действительно удалось выявить мутации в различных звеньях меланокортиновой системы гипоталамуса. Так что исследования механизмов развития и путей предотвращения МК-ожирения у мышей могут иметь в будущем вполне практический выход…
Желтая, толстая, больная. мышь
Не следует забывать, что наряду с центральной системой регуляции веса тела, локализованной в мозге, в организме существует и периферическая система. Она включает в себя такие органы, как печень, мышцы, жировая ткань, поджелудочная железа, кора надпочечников, желудок и др. Система реагирует на количество и качество съеденной пищи, на увеличение энергетических затрат, связанных с физической нагрузкой, терморегуляцией, умственной деятельностью.
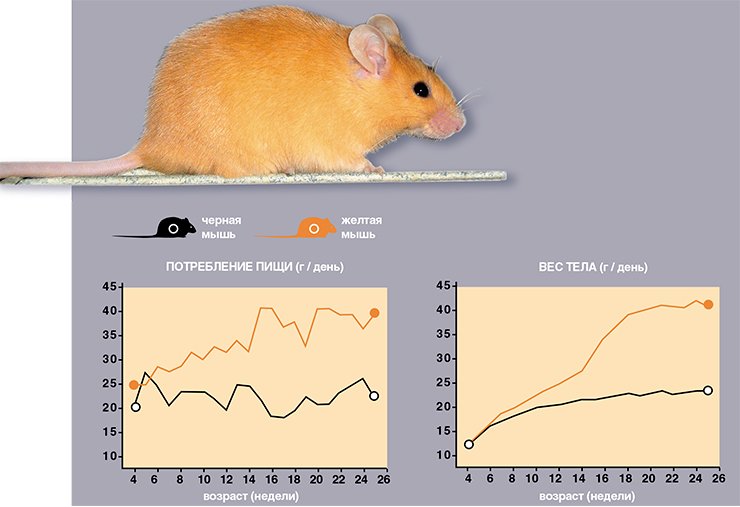
Известно, что основными носителями энергии, поступающей с пищей, являются жирные кислоты и глюкоза. В крови всегда должен поддерживаться постоянный уровень глюкозы (мозг не признает никаких других носителей энергии – только сладкое!). Избыток же энергии откладывается в виде жира. Процессы перераспределения энергетических ресурсов среди органов и тканей, использование их для нужд клеток регулируются гормонами поджелудочной железы (инсулином и глюкагоном), коры надпочечников, уровнем свободных жирных кислот в крови и многими другими гормонами и метаболитами жиров и углеводов.
Деятельность этой системы, регулирующей энергетический гомеостаз, при ожирении нарушается. В крови повыщаются уровни лептина, инсулина, глюкозы, жирных кислот, а чувствительность органов-мишеней к инсулину падает. Эти нарушения, названные синдромом ожирения, приводят, в свою очередь, к образованию тромбов, инсультам, нарушениям сердечного кровообращения и другим заболеваниям. Взрослые ожиревшие желтые мыши не являются исключением, у них также развивается диабет второго типа, однако при этом неясно, что есть причина, а что – следствие. Поэтому мы решили исследовать динамику веса тела, потребления пищи, концентраций в крови гормонов и энергетических субстратов у желтых мышей, контролем же послужили черные мыши, не склонные к ожирению.
Что же показал мониторинг мышиной жизни? Оказалось, что уже 6-недельные желтые мыши склонны к хроническому перееданию, что приводит к прогрессирующему увеличению веса. С возрастом различия в весе между мышами увеличиваются, и в возрасте 22 недели желтые самки весят в 2 раза больше черных! Вот к каким результатам приводит незначительное, но постоянное повышение аппетита, вызванное неуместной экспрессией Агути-белка.
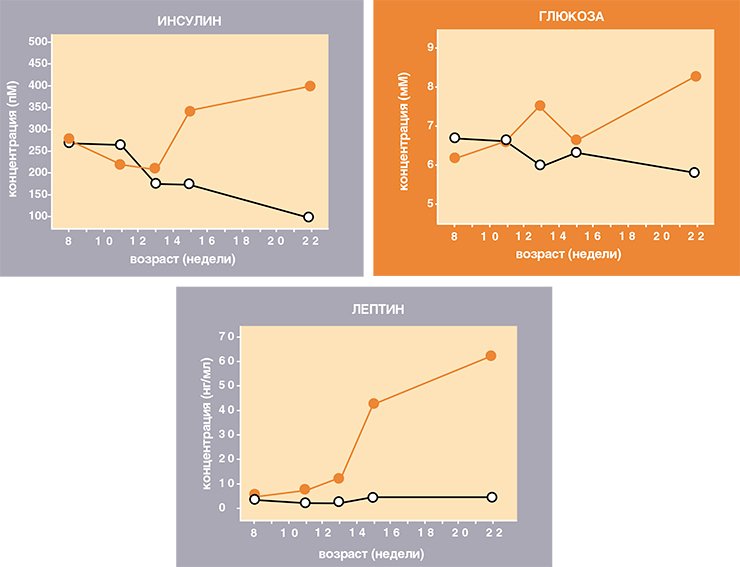
«Симптомы» ожирения у желтых мышей предшествуют появлению признаков диабета. В период с 8 по11 неделю жизни самки продолжают накапливать жир, о чем говорит повышенный уровень лептина, но пока не отличаются по другим показателям. Однако уже в возрасте 13 недель в крови у них повышаются уровни жирных кислот и глюкозы – первые грозные признаки развития нечувствительности к инсулину, когда ткани теряют способность под действием гормона захватывать из крови энергетические субстраты. Через две недели повышается уровень самого инсулина – как последняя попытка добиться ответа тканей, действуя не умением, но числом. Но все напрасно: после 15-недельного возраста происходит полная разбалансировка гормонально-метаболического статуса организма мышей. Все показатели достигают максимума – вес, аппетит, концентрации в крови лептина, инсулина, глюкозы, жирных кислот. Если же глюкозы много в крови, то, значит, она не может проникнуть в ткани, которые так в ней нуждаются, а это и есть диабет второго типа.
Любой биологический эксперимент не столько дает ответы, сколько ставит новые вопросы. Не обошлось без них и в нашем случае. Почему «лишний» Агути-белок, который постоянно нарабатывается в гипоталамусе желтых мышей, в первые недели жизни никак не влияет на аппетит и вес тела? Каким способом жир, накопленный в жировой ткани, может препятствовать действию инсулина на клетки других органов? Для ответа требуются дальнейшие эксперименты.
Беременные и стройные
Еще вопрос, возникающий после подобных экспериментов: можно ли предотвратить развитие ожирения? К сожалению, несмотря на заметный прорыв в нашем понимании механизмов развития ожирения, о возможных путях его купирования почти ничего не известно.
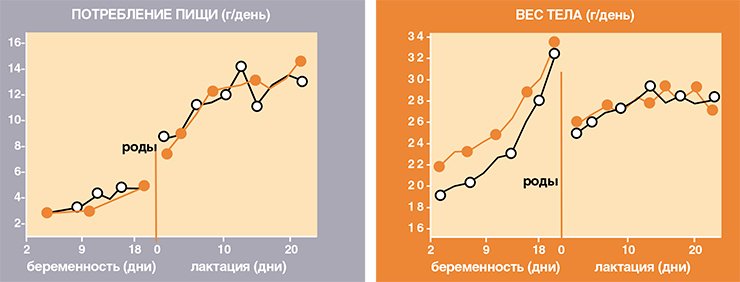
Занимаясь разведением желтых и черных мышей в виварии Института цитологии и генетики СО РАН, старший научный сотрудник, к. б. н. Е. Н. Макарова заметила, что желтые самки не набирают лишний вес в случае, когда приносят и выкармливают потомство. Это наблюдение заставило нас провести специальный эксперимент. Выяснилось, что если желтая самка забеременеет вскоре после полового созревания (в 8 недель), то к концу беременности она теряет свои «лишние» граммы и уже во время лактации практически не отличается по весу от всегда стройных черных особей.
В чем же причина этого удивительного явления? Сначала мы предположили, что у желтых самок, возможно, повышена плодовитость, и они тратят больше энергии на выкармливание помета, почему и не набирают лишний вес. Однако проверка показала, что это не так.
Затем мы изучили влияние беременности и лактации у желтых самок на аппетит и показатели углеводно-жирового обмена. Обычно при беременности, особенно во второй половине, когда плод интенсивно растет, аппетит повышается. И именно в это время что-то ломается в механизме действия мутации А у : желтые самки начинают есть меньше черных! В результате к родам желтые и черные самки приходят уже с равным весом тела Удивляет то, что и в дальнейшем, во время выкармливания желтые самки по потреблению пищи и метаболическим показателям почти не отличались от черных самок с нормальным метаболизмом.
Что же происходит с мутацией А у при беременности и лактации – особенных физиологических состояниях, испытать которые дано только «прекрасной» половине вида? У самок вообще не существует такой физиологической системы, функция которой не менялась бы в ходе размножения. Значительное напряжение при этом приходится и на систему регуляции энергетического баланса. Если у самцов большинства видов энергетические траты на размножение с оплодотворением яйцеклетки прекращаются, то у самок они только начинаются. И затраты эти немалые! У мелких млекопитающих аппетит самок, особенно при лактации, возрастает в 3—4 раза! Кормящая мышь при весе тела 26—28 грамм съедает в день 12—14 грамм пищи, то есть половину собственного веса. Такое потребление пищи – большой труд. Должна существовать сильнейшая пищевая мотивация, призванная повысить аппетит до степени, которая позволяет компенсировать огромные затраты энергии, связанные с выработкой молока.
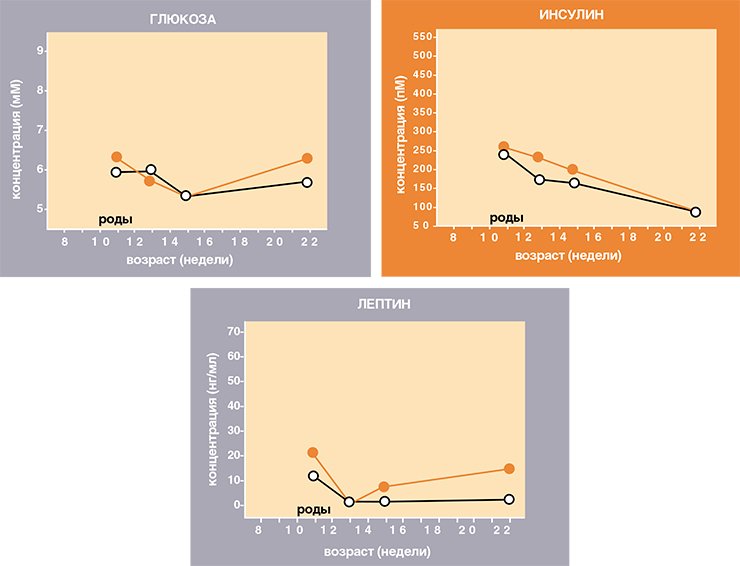
Действительно, показано, что при лактации значительно повышается продукция пептидов, стимулирующих аппетит, в том числе АПБ, сходного по структуре и свойствам с Агути-белком (Chen et al., 1999). Мы предполагаем, что при лактации продукция этого стимулирующего аппетит белка так высока, что он полностью блокирует связывание анорексигенного меланоцитостимулирующего гормона на рецепторах гипоталамуса, за счет чего потребление пищи многократно возрастает у всех мышей поголовно. На фоне такой мощной физиологической стимуляции аппетита прибавка в съеденной пищи, вызванная мутацией А у , и ее эффект на вес тела просто «теряется». Эту гипотезу мы собираемся проверить экспериментально в самое ближайшее время.
Если хочешь быть здоров – размножайся!
Осталось ответить еще на один непраздный вопрос: как долго у желтых мышей длится «оздоравливающее» действие репродуктивной функции на метаболизм? Мы измерили гормонально-метаболические показатели рожавших желтых самок почти через два месяца после окончания лактации и обнаружили, что в возрасте 22 недели все показатели у них находятся практически в норме. Таким образом, можно утверждать, что рождение потомства избавило, по крайней мере временно, желтых мышей от ожирения и связанного с ним диабета второго типа. Однако потребуется еще много экспериментов, чтобы объяснить этот феномен.
В заключение вернемся к человеку и его проблемам, связанным с ожирением. Наши результаты позволяют если не решить их, то хотя бы по-новому на них взглянуть. Так, широко распространено мнение, что беременность и лактация портят фигуру женщины. Но, как мы уже убедились, по крайней мере у мышей все происходит совсем наоборот.
После родов у женщины, так же как и у мышей, существует множество стимулов для продукции молока, начиная с гормональной регуляции и заканчивая самым видом младенца, его криком, запахом. У кормящей женщины для компенсации энергии, затраченной на выработку молока, резко повышается аппетит. И если женщине удается долго и в полном объеме кормить младенца грудью, то ее фигуре ничего не грозит. Если же повышенный после родов аппетит сочетается с нежеланием или невозможностью кормить младенца, то лишние килограммы обеспечены. Но виновата в этом вовсе не лактация, а как раз ее отсутствие.
Вероятно, рано или поздно наступит время, когда всех людей, страдающих ожирением, будут обязательно тестировать на наличие у них мутаций, затрагивающих меланокортиновую систему мозга. Не исключено, что молодые женщины из семей, предрасположенных к развитию такого генетического ожирения, воспользуются сведениями, полученными на желтых мутантных мышах: дабы избежать ожирения, они будут рожать и выкармливать детей. И согласитесь, ведь гораздо лучше тратить силы на выращивание своего потомства, чем на безнадежную и бессмысленную борьбу с лишним весом.
Бажан Н.М. и др. Изменения углеводно-жирового обмена в ходе развития меланокортинового ожирения у мышей с мутацией Agouti yellow //Росс. физиол. журн. им. И.М. Сеченова, 2005, № 12, в печати.
Cone R.D. et al. The arcuate nucleus as a conduit for diverse signals relevant to energy homeostasis //Int. J. Obes. Relat. Metab. Disord., 2001, v. 25, Suppl. 5, p. S63—S67.
Bultmann et al. Molecular characterization of the mouse agouti locus //Сell, 1992, v. 71, p. 1195—1204.
Chen P. et al. Altered expression of agouti-related protein and its colocalization with neuropeptide Y in the arcuate nucleus of the hypothalamus during lactation. //Endocrinology, 1999, v. 6, p. 2645—2650.
Исследования поддержаны грантом РФФИ (№ 04-04-48760)
Размер имеет значение
 Лозунг «хочешь похудеть – размножайся» вряд ли станет популярным в густонаселенных странах юго-восточной Азии. Но в России, где число жителей неуклонно падает, а доля женщин с избыточным весом возрастает, такой вывод ученых полностью отвечает самым заветным чаяниям как простых людей, так и государственных деятелей. Что случается не часто.
Лозунг «хочешь похудеть – размножайся» вряд ли станет популярным в густонаселенных странах юго-восточной Азии. Но в России, где число жителей неуклонно падает, а доля женщин с избыточным весом возрастает, такой вывод ученых полностью отвечает самым заветным чаяниям как простых людей, так и государственных деятелей. Что случается не часто.
Относительное снижение массы тела, которое наблюдается у размножающихся самок мышей с генетически детерминированным ожирением, сочетающееся к тому же с уменьшением аппетита, – факт действительно интригующий, порождающий ряд вопросов. Прежде всего снижение веса после родов и грудного вскармливания приходит в противоречие с нашим бытовым опытом, обогащенным рядом примеров прямо противоположного характера. В чем же причина столь разительных видовых отличий?
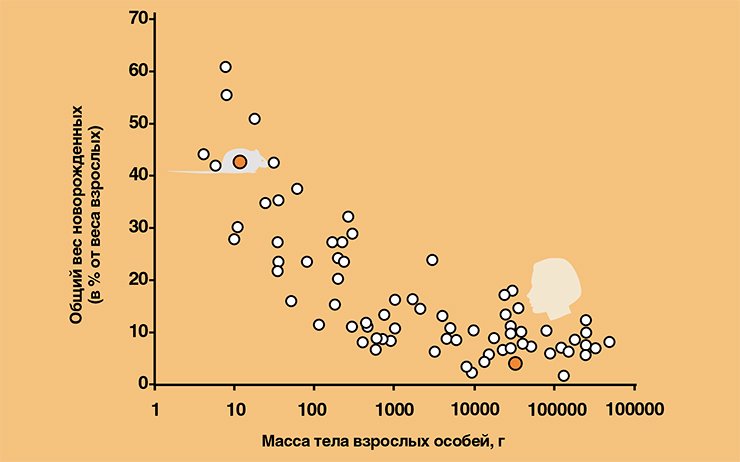
Важным обстоятельством, определяющим особенности биоэнергетики у разных видов, являются размеры тела. У мелких млекопитающих (например, у 6-граммовой крошки малой бурозубки, Crocidura suaveolens) вес всех новорожденных может достигать 50 % и более от собственного веса матерей. При увеличении размеров взрослых особей до 10 кг и выше относительная масса новорожденных чаще всего не превышает одну десятую материнской. Люди как биологический вид вполне вписываются в это правило: относительные размеры их новорожденных лежат в диапазоне, соответствующем размерному классу человека.
Чем больше относительные размеры потомства, тем, соответственно, выше энергетические затраты матерей. При этом нужно учесть, что поскольку мелкие животные имеют невыгодное в смысле теплопотерь соотношение поверхности и объема тела, интенсивность энергетического метаболизма на единицу массы тела по мере уменьшения размеров животных также возрастает. Поэтому энерготраты у мелких животных велики везде, куда ни посмотри. И хотя у них в этом же направлении изменяется и способность к максимальной ассимиляции энергии пищи, однако они не поспевают за ростом относительных размеров потомства.
В результате действия всех факторов у видов, чей вес меньше 1 кг, беременность и выкармливание зачастую протекает при отрицательном энергетическом балансе материнского организма. Узким местом, ограничивающим энергетическое обеспечение беременных самок, является желудочно-кишечный тракт (Wainer, 1987, 1992). Вот уж действительно «кишка тонка». У людей, как и у других млекопитающих с массой тела более 10 кг, таких проблем не возникает, поэтому беременность и может сопровождаться накоплением жира в материнском организме.
Итак, если снижение массы тела у беременных мышей вытекает из закономерностей энергетики, что же «заставляет» самок с генетически детерминированным ожирением уменьшать потребление корма? Частично ответ на этот вопрос дан в статье Н. М. Бажан. Но это лишь физиологическое объяснение феномена. А можно ли найти какой-нибудь адаптивный смысл в подобном снижении аппетита?
Логический анализ значимости биологического явления (иными словами, подмена естественного отбора собственными размышлениями) — занятие спекулятивное, но небесполезное. Как в любой философии, здесь лучше всего опереться на авторитеты, например на Ричарда Докинза. После его книги «Эгоистичный ген» легко согласиться с тем, что беременная и кормящая самка в качестве «машины для выживания генов» имеет большую ценность, чем небеременная. С этих позиций самка, вынашивающая 10 потомков, становится в 6 раз более ценной, поскольку в каждом детеныше содержится половина материнского генома. Поэтому если накопленные еще до беременности запасы жира достаточны для вынашивания и выкармливания потомства, то стоит ли рисковать, отправляясь на поиски корма? В реальной жизни мышей (и не только!) это занятие небезопасное: можно столкнуться с хищником, отравиться, получить пищевую инфекцию и т. д. В этом смысле даже патологическое ожирение матери можно рассматривать как крайнее выражение адаптации, направленной на безопасное обеспечение будущего потомства.
Следует отметить, что подобные адаптивные корни имеют многие неинфекционные болезни. Причем конкретные патогенетические механизмы «болезней адаптации» весьма разнообразны. В этой связи можно поздравить автора и ее коллег с тем, что им удалось выйти на перспективный путь изучения механизмов и разработки методов коррекции меланокортинового ожирения, которым страдает немало людей.
: 17 Мар 2006 , Клад тагарского жреца , том 8, №2https://scfh.ru/papers/beremennost-kak-sredstvo-borby-s-ozhireniem/